科(kē)研动态|我科(kē)吴斌教授团队发现NF-κBp65-Ser536為(wèi)肝癌关键药物(wù)靶点
2021年8月11日,Journal of Experimental & Clinical Cancer Research杂志(zhì)在線(xiàn)发表中(zhōng)山(shān)大學(xué)附属第三医(yī)院吴斌教授团队题為(wèi)“Phosphorylation of NF-κBp65 drives inflammation-mediated hepatocellular carcinogenesis and is a novel therapeutic target”的長(cháng)篇研究论著(中(zhōng)科(kē)院一區(qū),IF=11.161)(图1)。

图1:2021年8月11日J EXP CLIN CANC RES在線(xiàn)发表的论著全文(wén)。
该研究发现肝脏慢性炎症反应,尤其是TNF-α,诱发肝细胞NF-κBp65表达上调,进一步通过β-arrestin1介导NF-κBp65-Ser536位点磷酸化,继而激活下游Akt/mTOR信号通路,促进了肝癌的发生与发展。该研究是吴斌教授团队在Nature Communications发表题為(wèi)“β-arrestin1 enhances hepatocellular carcinogenesis through inflammation-mediated Akt signalling”及在Autophagy发表题為(wèi)“HBx induces hepatocellular carcinogenesis through ARRB1-mediated autophagy to drive the G1/S cycle”研究工(gōng)作(zuò)的延续及深入。
该团队在人肝癌组织样本及血液样本中(zhōng)检测发现NF-κB信号通路5个亚基NF-κB1、NF-κB2、p65(RelA)、RelB、c-Rel中(zhōng)尤以p65(RelA)的表达及磷酸化最显著。根据这个重要临床发现,该团队进一步通过肝细胞特异敲除(L- NF-κBp65 KO)小(xiǎo)鼠构建肝癌模型,与野生型小(xiǎo)鼠比较,L-NF-κBp65基因敲除后肝癌发生的数量、體(tǐ)积等均显著低于野生型小(xiǎo)鼠。在DEN、四氯化碳、TNF-α构建的3种小(xiǎo)鼠肝脏炎症模型中(zhōng),NF-κBp65的表达水平及磷酸化均显著升高;肝癌细胞实验及裸鼠成瘤实验中(zhōng),NF-κB信号通路抑制剂(Bay 11-7082、PDTC)明显抑制肝癌细胞的增殖及移植瘤的生長(cháng)。进一步通过β-arrestin1基因敲除小(xiǎo)鼠、肝癌细胞β-arrestin1基因沉默实验、及NF-κBp65磷酸化位点突变实验等进行深入的机制研究,发现β-arrestin1显著激活NF-κBp65-Ser536位点的磷酸化,但并不激活Ser276或Ser529位点的磷酸化,而Ser536位点的磷酸化活化了下游Akt/mTOR信号通路,结果诱发肝细胞的癌变及促进肝癌的发展(图2)。
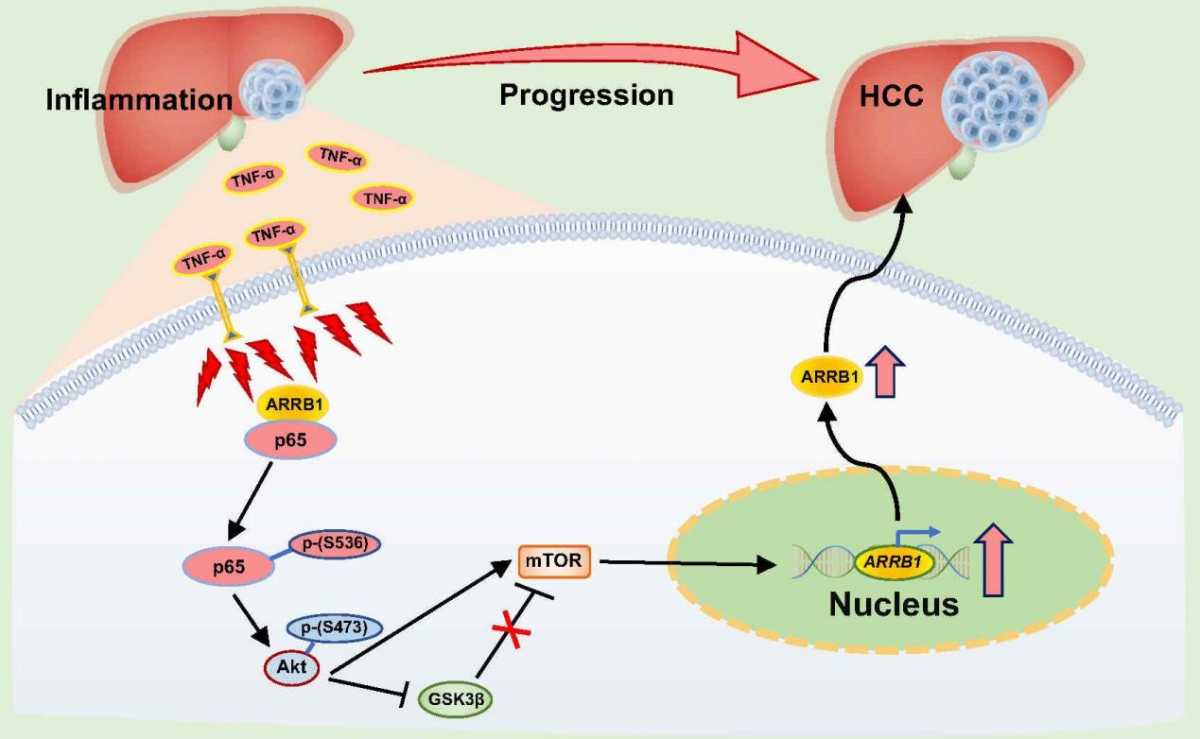
图2:在肝脏炎症微环境中(zhōng),TNF-α激活NF-κB信号通路,在β-arrestin1(ARRB1)诱导下NF-κBp65亚基Ser536位点磷酸化上调,从而活化下游Akt/mTOR信号通路,以诱发肝细胞的癌变及促进肝癌的发展。
此项研究為(wèi)理(lǐ)解肝脏炎症环境中(zhōng)NF-κBp65的显著上调及磷酸化在肝癌中(zhōng)的作(zuò)用(yòng)及相关机制提供了新(xīn)的科(kē)學(xué)依据,同时揭示了β-arrestin1诱导NF-κBp65-Ser536磷酸化的新(xīn)机制,為(wèi)NF-κBp65及其Ser536位点磷酸化作(zuò)為(wèi)肝癌防治的关键药物(wù)靶点提供了新(xīn)的理(lǐ)论基础。
吴斌教授的學(xué)生徐璇博士与雷一鸣博士為(wèi)此文(wén)的共同第一作(zuò)者,吴斌教授和杨逸冬副主任医(yī)师為(wèi)共同通讯作(zuò)者,中(zhōng)山(shān)大學(xué)附属第三医(yī)院為(wèi)论文(wén)第一作(zuò)者单位及通讯作(zuò)者单位。该研究获得國(guó)家自然科(kē)學(xué)重点项目及面上项目(U1501224与82070574)、广东省自然科(kē)學(xué)基金团队项目(2018B030312009)的支持。
论文(wén)链接:https://jeccr.biomedcentral.com/articles/10.1186/s13046-021-02062-x








